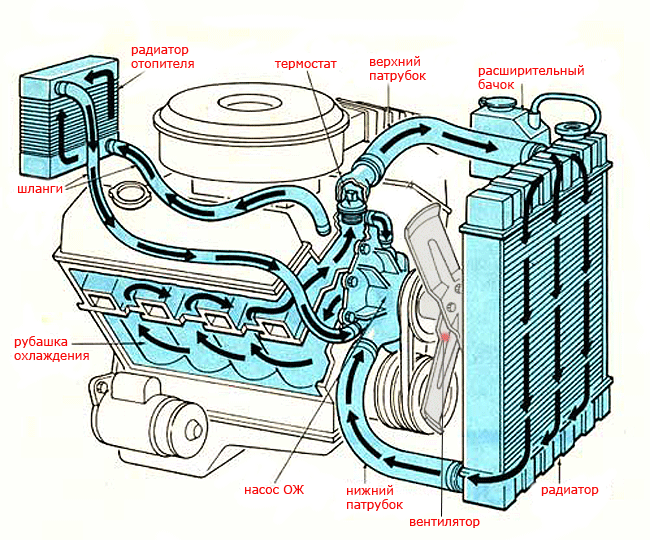
Этиленгликоль и пропиленгликоль. какая есть разница и можно ли их смешивать?
Содержание:
- Применение
- Первая помощь и выведение вещества из организма
- Что такое этиленгликоль
- В чем разница G12 и G11, G12 и G13
- История и производство
- Какой должна быть плотность антифриза
- Как проверить плотность охлаждающей жидкости
- Физические и теплофизическине свойства водных растворов глицерина
- Плотность водного раствора глицерина в зависимости от температуры и концентрации. Таблица.
- Концентрация глицерина по массе и по объёму в водном растворе
- Температура кипения смеси глицерина с водой (при нормальном атмосферном давлении)
- Температура замерзания смеси глицерина с водой (при нормальном атмосферном давлении)
- Важнейшие требования ГОСТ 19710 к готовому гликолю
- Что такое этиленгликоль
Применение
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
- Как компонент автомобильных антифризов и тормозных жидкостей, что составляет 60% его потребления. Смесь 60% этиленгликоля и 40% воды замерзает при −49 °С. Коррозионно активен, поэтому применяется с ингибиторами коррозии;
- Используется как теплоноситель с содержанием не более 50% в системах отопления (частные дома в основном)
- В качестве теплоносителя в виде раствора в автомобилях, в системах жидкостного охлаждения компьютеров;
- В производстве целлофана, полиуретанов и ряда других полимеров. Это второе основное применение;
- Как растворитель красящих веществ;
- В органическом синтезе:
- в качестве высокотемпературного растворителя.
- для защиты карбонильной группы путём получения 1,3-диоксолана. Обработкой вещества с карбонильной группой в бензоле или толуоле этиленгликолем в присутствии кислого катализатора (толуолсульфоновой кислоты, BF3•Et2O и др.) и азеотропной отгонкой на насадке Дина-Старка образующейся воды. Например, защита карбонильной группы изофорона
1,3-диоксоланы могут быть получены также при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана или комплекса диметилсульфат-ДМФА 1,3-диоксалана устойчивы к действию нуклеофилов и оснований. Легко регенерируют исходное карбонильное соединение в присутствии кислоты и воды.
- Как компонент противоводокристаллизационной жидкости «И».
- В качестве криопротектора.
- Для поглощения воды, для предотвращения образования гидрата метана (ингибитор гидратообразования), который забивает трубопроводы при добыче газа в открытом море. На наземных станциях его регенерируют путём осушения и удаления солей.
- Этиленгликоль является исходным сырьём для производства взрывчатого веществанитрогликоля.
Этиленгликоль также применяется:
- при производстве конденсаторов
- при производстве 1,4-диоксана
- как теплоноситель в системах чиллер-фанкойл
- в качестве компонента крема для обуви (1‒2 %)
- в составе для мытья стёкол вместе с изопропиловым спиртом
- при криоконсервировании биологических объектов (в крионике) в качестве криопротектора.
- при производстве полиэтилентерефталата, пластика популярных ПЭТ-бутылок.
Первая помощь и выведение вещества из организма
Алгоритм действий по оказанию помощи человеку, выпившему этиленгликоль или жидкость, его содержащую, таков:
- Вызвать бригаду скорой помощи;
- Промыть желудок содовым раствором (1 столовая ложка на 0,5 л воды);
- Давать обильное теплое питье: молоко, минеральная вода без газа;
- Дать выпить сорбент (активированный уголь, полисорб, энтеросгель);
- Дать слабительное, лучше всего подойдет магнезия.
Если пострадавший в сознании, и его состояние не тяжелое, хорошо дать выпить 100 мл водки или 50 мл медицинского спирта, разбавленного пополам с водой. Как это ни покажется странным, этиловый спирт является антидотом этого токсичного вещества, который можно применить в домашних условиях.
Если пострадавший без сознания, его нужно уложить на ровную поверхность, повернув голову набок во избежание асфиксии содержимым желудка в случае рвоты. Необходимо прощупать пульс и измерить давление. Пульс может быть нитевидным и даже не прощупываться на запястье, определять его нужно на сонных артериях – боковой поверхности шеи.
В случае остановки дыхания и отсутствия пульса нужно выполнить закрытый массаж сердца и принудительное искусственное дыхание.
В стационаре в качестве антидота при отравлении этиленгликолем вводится внутривенно стерильный щелочной раствор – бикарбонат натрия (сода), вводится глюконат кальция для восполнения его потери. Проводится восстановительная терапия, в зависимости от степени возникших нарушений. При тяжелом отравлении для очистки крови подключают аппарат гемосорбции (искусственная почка).
Что такое этиленгликоль
По определению этиленглико́ль (гликоль, 1,2-диоксиэтан, этандиол-1,2) — кислородсодержащее органическое соединение, двухатомный спирт, простейший представитель многоатомных спиртов. Если вещество очищено, то представляет собой прозрачную бесцветную жидкость маслянистой консистенции.
Изначально этиленгликоль использовался во времена Первой мировой войны в качестве глицерина. Однако со временем изменил свое направление. Его стали использовать в различных сферах химической промышленности.
Формула и класс вещества
Химическая формула гликоля — C2H6O2, рациональная — C2H4 (OH) 2, структурная — HO—CH2—CH2—OH . В основе молекулы лежит непредельный скелет этилена, который состоит из двух атомов карбона. На свободные валентные места присоединились две гидроксильные группы.
У этиленгликоля есть несколько названий, которые зачастую встречаются в составе продуктов химического производства:
- гликоль;
- этандиол-1,2;
- 1,2-диоксиэтан.
Молекула имеет подобие транс-конфигурации в размещении гидроксильных групп. Такое расположение соответствует самому удаленному расположению водородов, что дает максимальную устойчивость системы.
Как получают
Массовое получение 1.2-этандиола началось еще в тридцатые годы прошлого века. Сначала получали лишь одним методом, потом появились новые. Таким образом, гликоль можно получить несколькими способами, однако некоторые из них стали частью истории, а другие превзошли их качеством.
Изначально 1,2-диоксиэтан получали из дибромэтана. Двойная связь этилена разрывается, а свободные валентности занимаются галогенами — исходным веществом в данной реакции. Образование промежуточного соединения возможно благодаря замещению ацетатными группами, которые при гидролизе превращаются в спиртовые.
С улучшением технологий появился новый метод — получение этиленгликоля прямым гидролизом любых этанов и этиленов , которые замещены двумя галогенами соседних атомов карбона. С помощью различных водных растворов, карбонатов металлов, воды и диоксида свинца начинается реакция, которая возможна лишь при больших температурах и давлении. Побочные вещества — диэтиленгликоль и триэтиленгликоль.
Следующий способ позволил получать 1,2-диоксиэтан из эфира этиленхлоргидрина путем его гидролиза угольными солями. При 170 градусах выход целевого продукта достигал 90 %. Однако был значительный недостаток — гликоль необходимо извлекать из раствора соли. Ученые решили эту проблему. Они разбили процесс на две стадии, при этом оставив то же исходное вещество.
Гидролиз этиленгликоль ацетатов стал отдельным способом, когда получилось добыть исходный реагент путем окисления этилена в уксусной кислоте кислородом.
В чем разница G12 и G11, G12 и G13
Основные виды антифризов, такие как G11, G12 и G13 отличаются по виду используемых присадок: органические и неорганические.
Общие сведения об антифризах, в чем между ними отличие и как подбирать нужную ОЖ
Охлаждающая жидкость класса G11 неорганического происхождения с малым набором присадок, наличием фосфатов и нитратов. Такой антифриз создан по силикатной технологии. Силикатные присадки покрывают внутреннюю поверхность системы сплошным защитным слоем в не зависимости от наличия участков коррозии. Хотя такой слой и защищает уже существующие очаги коррозии от разрушений. Такой антифриз имеет низкую стабильность, ухудшенную теплоотдачу и небольшой строк эксплуатации, после выработки, которого, выпадает в осадок, образовывающий абразив и повреждающий тем самым .
Через то, что антифриз G11 создает слой подобный накипи в чайнике, он не подходит для охлаждения современных авто, имеющих радиаторы с тонкими каналами. К тому же, температура кипения такой охлаждайки составляет 105 °С, а строк службы не более 2-х лет или 50-80 тыс. км. пробега.
Зачастую антифриз G11 окрашивается в зеленый или синий цвета. Такую ОЖ применяют для автомобилей, выпущенных до 1996 года и машины с большим объёмом охлаждающей системы.
G11 плохо подходит к алюминиевым радиаторам и блокам, так как его присадки не могут должным образом защищать этот металл при высоких температурах.
В Европе авторитетная спецификация классов антифризов принадлежит концерну Volkswagen поэтому соответствующая маркировка VW TL 774-C предусматривает использование в антифризе неорганических присадок и имеет обозначение G 11. Спецификация VW TL 774-D предусматривает наличие карбо-кислотных добавок на органической основе и маркируется как G 12. Стандартами VW TL 774-F и VW TL 774-G маркируются классы G12 + и G12 ++, а самый сложный и дорогостоящий антифриз G13 регламентируется стандартом VW TL 774-J. Хотя другие производители такие как Форд или Тойота имеют свои стандарты качества. Кстати разницы между тосолом и антифризом нету. Тосол – одна из марок русского минерального антифриза, которая не рассчитан на работу в моторах с алюминиевым блоком.
Органические и неорганические антифризы смешивать категорически нельзя, поскольку возникнет процесс свертывания и в результате появится осадок в виде хлопьев!
А жидкости классов G12, G12 + и G13 разновидности органических антифризов «Long Life». Применяются в системах охлаждения современных авто выпускаемых начиная с 1996 г. G12 и G12 + на основе этиленгликоля но только G12 plus предполагает использование гибридной технологии производства в которой объединили силикатную технологию с карбоксилатную. В 2008 году появился еще и класс G12++, у такой жидкости, органическая основа сочетается с небольшим количеством минеральных присадок (называется лобридной Lobrid или SOAT coolants). У гибридных антифризах органические присадки смешиваются вместе с неорганическими (могут применяться силикаты, нитриты и фосфаты). Такое объединение технологий дало возможность устранять главный недостаток антифриза G12 – не только устранять коррозию, когда она уже появилась, но и выполнять профилактическое действие.
G12+, в отличии от G12 или G13 может быть смешана с жидкостью класса G11 или G12, но все равно такой «микс» не рекомендован.
Охлаждающая жидкость класса G13 начала производится с 2012-го и рассчитана для автомобильных двигателей работающих в экстремальных режимах. С технологической точки зрения отличий от G12 не имеет, единственная разница в том, что сделана на пропилен гликоле, который менее ядовитый, быстрее разлагается, а значит, наносит меньший вред окружающей среде при его утилизации и его цена значительно выше G12-го антифриза. Изобретался исходя из требований к повышению экологических норм. Антифриз G13, как правило, фиолетового или розового цвета, хотя на самом деле может окрашиваться любым цветом, так как это всего лишь краситель, от которого её характеристики не зависят, разные производители могут выпускать ОЖ с разными цветами и оттенками.
Разница в действии карбоксилатного и силикатного антифризов
История и производство
Чистый EGDN был впервые получен бельгийским химиком Луи Генри (1834–1913) в 1870 году путем добавления небольшого количества этиленгликоля в смесь азотной и серной кислот, охлажденную до 0 ° C. В прошлом году Август Кекуле произвел EGDN нитрованием этилена , но на самом деле он был загрязнен бета-нитроэтилнитратом .
Другие исследователи, готовившие NGc перед публикацией в 1926 году работы Ринкенбаха, включали: Чемпиона (1871), Неффа (1899) и Виланда и Сакеллариоса (1920), Даутриче, Хоу и Эхме.
Американский химик Уильям Генри Ринкенбах (1894–1965) получил EGDN путем нитрования очищенного гликоля, полученного фракционированием коммерческого продукта под давлением 40 мм рт. Ст. И при температуре 120 °. Для этого 20 г средней фракции очищенного гликоля постепенно добавляли к смеси 70 г азотной кислоты и 130 г серной кислоты, поддерживая температуру на уровне 23 °. Полученные 49 г сырого продукта промывали 300 мл воды с получением 39,6 г очищенного продукта. Полученный таким образом низкий выход можно улучшить, поддерживая более низкую температуру и используя другую смесь нитрующих кислот.
1) Прямое нитрование гликоля проводится точно так же, на том же аппарате и с теми же смешанными кислотами, что и нитрование глицерина. В тесте нитрование безводного гликоля (100 г) 625 г смешанной кислоты HNO340% и H2ТАК460% при 10-12 °, выход составил 222 г, а при повышении температуры до 29-30 ° он упал до 218 г. Когда 500 г смешанной кислоты HNO350% и H2ТАК450% использовали при 10-12 °, выход увеличился до 229 г. При коммерческом нитровании выходы, полученные из 100 кг безводного гликоля и 625 кг смешанной кислоты, содержащей HNO.341%, H2ТАК458% и вода 1% составили 222,2 кг NGc при температуре нитрования 10-12 ° и только 218,3 кг при 29-30 °. Это означает 90,6% от теории по сравнению с 93,6% от NG.
- C 2 H 4 (OH) 2 + 2 HNO 3 → C 2 H 4 (ONO 2 ) 2 + 2 H 2 O
или посредством реакции оксида этилена и пятиокиси азота
- С 2 Н 4 О + N 2 О 5 → С 2 Н 4 (ONO 2 ) 2
2) Прямое производство NGc из газообразного этилена . 3) Получение NGc из оксида этилена . 4) Получение NGc методом Мессинга из этилена через хлоргидрин и оксид этилена. 5) Приготовление НГК по методу Дюпон .
Какой должна быть плотность антифриза
После того как вы получили все необходимые показатели жидкости, их нужно сверить с показателями из таблицы. Если концентрация этиленгликоля составляет 85,4 %, а температура кристаллизации равна -40 градусам, то плотность смеси должна быть не менее 1,104 г/см 3 . По аналогии вы можете определить любую величину, и узнать при какой плотности будет тот или иной порог замерзания состава.
Для удобства представим показатели нормальной плотности для самых популярных антифризов:
- плотность жидкости Liqui Moly KFC составляет 1,113 г/см 3 ;
- для тосола «Тораса» ОЖ40 этот показатель составляет 1,087 г/см 3 ;
- Castrol Radiocool имеет значение плотности 1,122 г/см 3 ;
- плотность Mobil Antifreeze Advanced составляет от 1,122 до 1,125 г/см 3 ;
- для Mannol Longlife AF12+ стандартное значение – 1,085 г/см 3 .
Многие антифризы изготавливают с запасом, то есть их температура замерзания может составлять до -60 градусов. Таких холодных арктических зим у нас не бывает, поэтому такие «охладители» можно без зазрения совести разбавить водой, чтобы добиться порога кристаллизации состава при -35 градусах.
Как проверить плотность охлаждающей жидкости
Плотность антифриза необходимо обязательно вычислить правильно. Для этого нужно выполнить несколько условий
Во-первых, важно выдержать температурный режим, который должен составлять 20 градусов или близкое к этому значение. Если вы будете замерять плотность, как только двигатель машины был остановлен, то получите неправильные данные
Поэтому лучше использовать обычный градусник и проверить температуру.
Во-вторых, для определения плотности используется специальный прибор – ареометр. Можно приобрести и более дорогостоящий девайс – рефрактометр, но переплачивать за него смысла нет. Ареометр – это колба со стержнем, на котором, как и на градуснике существуют градации. На конце измерителя есть резиновая или пластиковая пипетка, с помощью которой производится забор жидкости. Корпус прибора изготовлен из прозрачного пластика или стекла, поэтому при его использовании также не допускаются большие температуры.
Плотность антифриза измеряется также как тосола, и определяется она следующим методом:
Остудите двигатель до необходимой температуры в 20 градусов.
Осторожно откройте крышку расширительного бачка или радиатора (в зависимости от типа конструкции системы охлаждения).
С помощью груши, которая находится на одном из концов ареометра, произведите забор жидкости.
Установите ареометр в вертикальное положение и зафиксируйте его.
Запишите показания прибора.
Если полученные данные сильно разнятся с обозначениями на этикетке с антифризом, то такую жидкость лучше всего вообще заменить.
Чтобы узнать плотность антифриза, таблица данных которой представлена ниже, можно использовать более современные ареометры, оснащенные дополнительной шкалой, позволяющей одновременно измерить температуру замерзания. В этом случае вам не понадобится производить никаких дополнительных вычислений.
| Концентрация этиленгликоля, % | Плотность смеси, г/см 3 | Температура замерзания, °С | Концентрация этиленгликоля, % | Плотность смеси, г/см 3 | Температура замерзания, °С |
| 26,4 | 1,0340 | -10 | 65,3 | 1,0855 | -65 |
| 27,2 | 1,0376 | -12 | 65,6 | 1,0860 | -66 |
| 29,6 | 1,0410 | -14 | 66,0 | 1,0863 | -67 |
| 32,0 | 1,0443 | -16 | 66,3 | 1,0866 | -68 |
| 34,2 | 1,0480 | -18 | 68,5 | 1,0888 | -66 |
| 36,4 | 1,0506 | -20 | 69,6 | 1,0900 | -64 |
| 38,4 | 1,0533 | -22 | 70,8 | 1,0910 | -62 |
| 40,4 | 1,0560 | -24 | 72,1 | 1,0923 | -60 |
| 42,2 | 1,0586 | -26 | 73,3 | 1,0937 | -58 |
| 44,0 | 1,0606 | -28 | 74,5 | 1,0947 | -56 |
| 45,6 | 1,0627 | -30 | 75,8 | 1,0960 | -54 |
| 47,0 | 1,0643 | -32 | 77,0 | 1,0973 | -52 |
| 48,2 | 1,0663 | -34 | 78,4 | 1,0983 | -50 |
| 49,6 | 1,0680 | -36 | 79,6 | 1,0997 | -48 |
| 51,0 | 1,0696 | -38 | 81,2 | 1,1007 | -46 |
| 52,6 | 1,0713 | -40 | 82,5 | 1,1023 | -44 |
| 53,6 | 1,0726 | -42 | 83,9 | 1,1033 | -42 |
| 54,6 | 1,0740 | -44 | 85,4 | 1,1043 | -40 |
| 55,6 | 1,0753 | -46 | 86,9 | 1,1054 | -38 |
| 56,8 | 1,0766 | -48 | 88,4 | 1,0660 | -36 |
| 58,0 | 1,0780 | -50 | 90,0 | 1,1077 | -35 |
| 59,1 | 1,0790 | -52 | 91,5 | 1,1987 | -34 |
| 60,2 | 1,0803 | -54 | 93,0 | 1,1096 | -33 |
| 61,2 | 1,0813 | -56 | 94,4 | 1,1103 | -32 |
| 62,2 | 1,0823 | -58 | 95,0 | 1,1105 | -28 |
| 63,1 | 1,0833 | -60 | 95,5 | 1,1107 | -27 |
| 64,0 | 1,0843 | -62 | 96,5 | 1,1110 | -24 |
| 64,8 | 1,0850 | -64 | 97,0 | 1,1116 | -22 |
Если перед тем как проверить плотность антифриза вы не остудили двигатель машины до 20 градусов, то замерную плотность, которая обозначается как t, можно привести к необходимой температуре с помощью формулы:
- P20 – это обозначение плотности антифриза при 20 градусах (в таблице обычно указывается в г/см 3 );
- Pt – это плотность хладагента при температуре замера (измеряется в г/см 3 );
- t – это фактическая температура охлаждающей жидкости на момент измерения (в таблице указывается как °С);
- γ – поправка плотности этиленгликоля (при учете что на каждый градус приходится 0,000525 г/см 3 ).
Физические и теплофизическине свойства водных растворов глицерина
Плотность водного раствора глицерина в зависимости от температуры и концентрации. Таблица.
Плотность смеси глицерина и воды приведена в таблице для концентрации глицерина от 10% до 70% по массе в диапазоне температур от нуля до ста градусов Цельсия.
| Температура, °C | Плотность водного раствора глицерина (содержание в процентах по массе) / ρ, г/см3 | ||||||
| 10% | 20% | 30% | 40% | 50% | 60% | 70% | |
| 1,025 | 1,052 | 1,079 | 1,107 | 1,135 | 1,163 | 1,192 | |
| 20 | 1,022 | 1,047 | 1,073 | 1,099 | 1,126 | 1,154 | 1,181 |
| 40 | 1,016 | 1,039 | 1,064 | 1,089 | 1,115 | 1,142 | 1,169 |
| 60 | 1,006 | 1,030 | 1,053 | 1,078 | 1,103 | 1,130 | 1,156 |
| 80 | 0,994 | 1,017 | 1,041 | 1,066 | 1.091 | 1,117 | 1.144 |
| 100 | 0,982 | 1,004 | 1,027 | 1,052 | 1,077 | 1,104 | 1,302 |
Вязкость водного раствора глицерина приводится в таблице в диапазоне температур смеси от нуля до ста градусов Цельсия и концентрации глицерина от 10% до 70%. Примечательно, что добавление всего лишь 10% (по массе) глицерина в воду позволяет повысить динамическую вязкость раствора на 30%.
| Температура, °C | Вязкость абсолютная (динамическая) водного раствора глицерина (содержание в процентах по массе) μ, Па*с | ||||||
| 10% | 20% | 30% | 40% | 50% | 60% | 70% | |
| 2,44*10-3 | 3,44*10-3 | 5,14*10-3 | 8,25*10-3 | 14,6*10-3 | 29,9*10-3 | 76,0*10-3 | |
| 20 | 1,31*10-3 | 1,76*10-3 | 2,5*10-3 | 3,72*10-3 | 6,0*10-3 | 10,8*10-3 | 22,5*10-3 |
| 40 | 0,826*10-3 | 1,07*10-3 | 1,46*10-3 | 2,07*10-3 | 3,10*10-3 | 5,08*10-3 | 9,4*10-3 |
| 60 | 0,575*10-3 | 0,731*10-3 | 0,956*10-3 | 1,30*10-3 | 1,86*10-3 | 2,85*10-3 | 4,86*10-3 |
| 80 | — | — | 0,69*10-3 | 0,918*10-3 | 1,25*10-3 | 1,84*10-3 | 2,9*10-3 |
| 100 | — | — | — | 0,668*10-3 | 0,91*10-3 | 1,28*10-3 | 1,93*10-3 |
Значения теплопроводности водного раствора глицерина показаны в таблице для диапазона температур от 20 до 80 градусов Цельсия и концентрации глицерина от 10% до 70%. С увеличением концентрации глицерина теплопроводность водного раствора снижается. При содержании 50% глицерина теплопроводность смеси примерно на 29% меньшей, чем у чистой воды.
| Температура | Теплопроводность смеси глицерина (содержание в процентах по массе) с водой Вт/(м*°C) | ||||||
| 10% | 20% | 30% | 40% | 50% | 60% | 70% | |
| 20 | 0,557 | 0,519 | 0,481 | 0,448 | 0,414 | 0,381 | 0,352 |
| 40 | 0,586 | 0,540 | 0,502 | 0,460 | 0,423 | 0,385 | 0,356 |
| 60 | 0,611 | 0,565 | 0,519 | 0,477 | 0,435 | 0,393 | 0,360 |
| 80 | 0,636 | 0,590 | 0,540 | 0,494 | 0,448 | 0,402 | 0,364 |
Оценочные значения теплоемкости водного раствора глицерина приводятся в таблице для температур от 20 до 80 градусов Цельсия и концентраций глицерина от 10 до 70%. С увеличением концентрации глицерина теплопроводность раствора снижается. При нормальных условиях и содержании 10% глицерина теплоемкость смеси примерно в 2 раза меньше теплоемкости чистой воды.
| Температура, °С | Теплоемкость смеси глицерина (содержание в процентах по массе) с водой кДж/(кг*°C) | ||||||
| 10% | 20% | 30% | 40% | 50% | 60% | 70% | |
| 20 | 1,998 | 1,907 | 1,816 | 1,725 | 1,634 | 1,542 | 1,452 |
| 40 | 2,002 | 1,916 | 1,830 | 1,744 | 1,659 | 1,573 | 1,487 |
| 60 | 2,010 | 1,929 | 1,848 | 1,767 | 1,687 | 1,606 | 1,525 |
| 80 | 2,024 | 1,948 | 1,871 | 1,795 | 1,718 | 1,642 | 1,608 |
Концентрация глицерина по массе и по объёму в водном растворе
В таблице ниже приведены соотношения концентрации глицерина в водном растворе по массе и по объёму.
| Концентрация глицерина в водном растворе по массе | 5% | 10% | 20% | 30% | 40% | 50% | 60% | 70% |
| Концентрация глицерина по объёму в водном растворе | 4,0% | 8,1% | 16,58% | 25,49% | 34,84% | 44,63% | 54,86% | 65,56% |
Температура кипения смеси глицерина с водой (при нормальном атмосферном давлении)
- Вода (без глицерина): 100°C
- Вода (90%) + Глицерин (10%): 100.7°C
- Вода (70%) + Глицерин (30%): 102,9°C
- Вода (50%) + Глицерин (50%): 106,7°C
- Глицерин (80%) + Вода (20%): 121,5°C
- Глицерин (90%) + Вода (10%): 139,8°C
- Глицерин (95%) + Вода (5%): 168 °C
Температура замерзания смеси глицерина с водой (при нормальном атмосферном давлении)
Источник, в основном: Богданов, Бурцев, Иванов, Куприянова «Холодильная Техника, Кондиционирование воздуха. Свойства веществ. » СПб. 1999
- Вода (90%) + Глицерин (10%): -2,2°C
- Вода (70%) + Глицерин (30%): -8,8°C
- Вода (50%) + Глицерин (50%): -21,4°C
- Глицерин (70%) + Вода (30%): -41,5°C
Важнейшие требования ГОСТ 19710 к готовому гликолю
С 1984 года действует ГОСТ 19710, который устанавливает требования к тому, какие свойства (температура замерзания, плотность и так далее) должен иметь этиленгликоль, используемый на предприятиях автомобилестроения и в других отраслях народного хозяйства, где на его основе выпускают разнообразные составы.
По ГОСТ 19710 гликоль (как жидкость) может быть двух типов: первого сорта и высшего сорта. Доля (массовая) воды в гликоле первого сорта должна быть до 0,5 %, высшего – до 0,1 %, железа – до 0,00005 и 0,00001 %, кислот (в пересчете на уксусную кислоту) – до 0,005 и 0,0006 %. Остаток после прокаливания готового продукта не может быть более 0,002 и 0,001 %.
Цвет 1,2-диоксиэтана по ГОСТ 19710 (по шкале Хазена):
- после кипячения в растворе кислоты (соляной) – 20 единиц для продукции высшего сорта (первый сорт не нормируется по цвету);
- в стандартном состоянии – 5 (высший сорт) и 20 единиц (первый сорт).
В Государственном стандарте 19710 выдвигаются специальные требования к процессу производства описываемого простейшего спирта:
- используется исключительно герметичная аппаратура и оборудование;
- производственное помещение обязательно оснащается вентиляцией, рекомендованной для работы с соединениями, которым присвоен третий класс опасности;
- при попадании гликоля на оборудование или землю его следует сразу же обильно смывать водной струей;
- персонал, работающий в цеху по производству 1,2-этандиола, обеспечивается противогазом модели «БКФ» либо иным приспособлением для защиты органов дыхания, соответствующим ГОСТ 12.4.034;
- возгорания гликоля тушат при помощи инертных газов, специальных пенных составов, а также тонкораспыленной воды.
Готовая продукция по ГОСТ 19710 проверяется различными методами. Например, массовая часть двухатомного спирта и диэтиленгликоля устанавливается способом изотермической газовой хроматографии по технологии так называемого «внутреннего эталона». При этом используются весы для лабораторных исследований (ГОСТ 24104), стеклянная или стальная газохроматографическая колонка и хроматограф с детектором ионизационного типа, измерительная линейка, микрошприц, лупа оптическая (ГОСТ 25706), выпарительная чашка и другой инструмент.
Цвет гликоля устанавливают по стандарту 29131 при помощи секундомера, специального цилиндра, конической колбы, соляной кислоты, холодильного агрегата. Массовая часть железа устанавливается по Госстандарту 10555 по методике сульфациловой фотометрии, остатка после прокаливания – по Госстандарту 27184 (посредством выпаривания полученного соединения в платиновой либо кварцевой емкости). А вот массовая часть воды определяется электрометрическим или визуальным титрованием с использованием реактива Фишера в бюретках емкостью 10 либо 3 кубических сантиметра.
Что такое этиленгликоль
Этиленгликоль — это представитель спиртов с двумя метильными группами в своём составе. Но в отличие от других он имеет немного маслянистую консистенцию.
Несмотря на то что этиленгликоль был получен ещё в 1859 году, он не сразу занял свою нишу в химии и промышленности. Изначально он использовался во времена Первой мировой войны, как замена глицерина, который широко применялся при производстве взрывчатых веществ.
Химическая формула этиленгликоля — C2H6O2, рациональная — С2Н4(ОН)2. По своим физическим свойствам — это жидкость без запаха, но со сладким вкусом. Он легко соединяется с водой в любой консистенции, что успешно применяется в промышленности, ведь температура замерзания таких жидкостей очень низкая — это улучшает свойства «незамерзаек».
У этиленгликоля есть несколько названий, которые нередко можно встретить в составе продуктов химического производства:
- гликоль;
- этандиол-1,2;
- 1,2-диоксиэтан.
Чаще других употребляется основное название.
К какому классу опасности относится этиленгликоль? — к умеренно токсичное легковоспламеняющееся вещество.
Способы получения
Производством этиленгликоля в промышленных масштабах занялись ещё в тридцатые годы прошлого века. Одним из способов его получения тогда было окисление этилена до его оксида. Около 20 лет такой метод оставался единственным.
Немного позже этиленгликоль стали получать с помощью насыщения оксида этилена водой, в присутствии серной и ортофосфорной кислот. Этот способ оказался выгодней предыдущего, так как на выходе производили более 90% этиленгликоля с минимальным количеством примесей.
Где применяется
В основном этиленгликоль используют в промышленности для обработки техники, что обусловлено его стоимостью — это недорогой и всем доступный продукт.
Он выпускается в химической промышленности для ухода за автомобилями:
- более 50% вещества идёт на создание тормозных жидкостей и антифризов, так как смесь гликоля и воды способна сохранять жидкую консистенцию даже при 40º C ниже нуля;
- этиленгликоль входит в состав охлаждающей жидкости — тосола;
- он может устранять коррозию, поэтому гликоль добавляют в антикоррозийные химические соединения.
Где ещё используется этиленгликоль?
- Его можно обнаружить в составе антистатиков.
- Используют для производства средств защиты против обледенения.
- Служит смазкой в холодильных установках.
- Находит применение этиленгликоль как наполнитель в гидравлических системах.
- Гликоль нередко используют для дезинфекции больших помещений.
- Одно из ключевых применений вещества — это производство бытовых химических продуктов, к числу которых относится целлофан, полиуретан.
- Он используется не только при охлаждении автомобилей, но и компьютеров.
- Этиленгликоль или химические соединения в составе с ним применяется, как средство для чистки автомобильных стёкол и зеркал.
- В небольшом количестве присутствует в креме для обработки обуви.
- Применяется этиленгликоль и в медицине, как составная часть криопротекторов для тканей и органов. То есть веществ, которые используют для заморозки.
- Это один из компонентов конденсаторов.
- Ключевым свойством этиленгликоля является поглощение воды, что успешно используется, чтобы предотвратить обледенение топлива в авиации и синтеза гидрата метана в трубопроводах, которые проходят в море.
- В органической химии его применяют как высокотемпературный растворитель.
- Без него не проходит синтез химических соединений.
- Где ещё используется этиленгликоль? — даже в наше время с его участием создают взрывчатые вещества.
За прошедшие десятилетия для этого двухатомного спирта нашлось множество применений, что, конечно же, обусловлено его свойствами. Но в медицине он известен не только как полезный и нужный продукт в быту, но и как средство, после контакта с которым человек может умереть.
Так что это такое этиленгликоль? — полезное химическое вещество, без которого не обходится производство большинства органических соединений или сильнодействующий яд с мощным отравляющим эффектом? Давайте узнаем, как может повлиять этиленгликоль на человека.